Mentefacto Conceptual Compuestos Inorgánicos
Paquete Proposicional:
Supraordinada
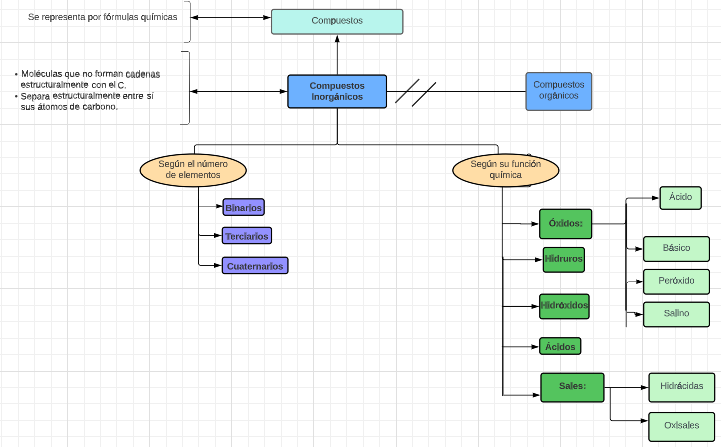
P1.1: Todo compuesto inorgánico es compuesto.
Isoordinada
P2.1. Todo compuesto inorgánico es compuesto representado por fórmulas químicas.
P2.2: Todo compuesto inorgánico es sustancia que no forma cadenas estructurales con el C.
P2.3: Todo compuesto inorgánico separa estructuralmente sus átomos de carbono.
Exclusión
P3. Ningún compuesto inorgánico es compuesto orgánico.
Infraordinadas
P4.1: Algún compuesto inorgánico según su funcionalidad química es óxido.
P4.1.1.1 Algún óxido es óxido ácido.
P41.1.2 Algún óxido es óxido básico.
P4.1.1.3 Algún óxido es peróxido.
P4.1.1.4 Algún óxido es óxido salino.
P4.1.2: Algún compuesto inorgánico según su funcionalidad química es hidruro.
P4.1.3: Algún compuesto inorgánico según su funcionalidad química es hidróxido.
P4.1.4: Algún compuesto inorgánico según su funcionalidad química es ácido.
P4.1.5: Algún compuesto inorgánico según su funcionalidad es sal.
P4.2.1: Algún compuesto inorgánico según el número de elementos es binario.
P4.2.2: Algún compuesto inorgánico según el número de elementos es terciario.
P4.2.3: Algún compuesto inorgánico según el número de elementos es cuaternario.
- Mentefactos Proposicionales
Argumentaciones:
P1: Todo compuesto inorgánico es compuesto.
Los compuestos son sustancias que están formadas por un mínimo de 2 elementos que han reaccionado entre sí para dar origen a otra sustancia diferente a los elementos iniciales (reactivos) y así formando un producto, el cuál puede ser orgánico o inorgánico. Los elementos quedan unidos por lo que se conoce como un “enlace químico". (Lifeder Educación , 2022) (Wöhler, n.d.)
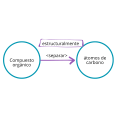
Un compuesto inorgánico es cualquier compuesto que carece de un átomo de carbono. Existe un pequeño número de compuestos inorgánicos que contienen carbono, dada su propensión a formar enlaces moleculares, como el monóxido de carbono y el dióxido de carbono, por nombrar algunos. (Calderón et al., 2014) (Diferenciador , n.d.)
P2.1. Todo compuesto inorgánico es compuesto representado por fórmulas químicas.
Argumentación: Los compuestos orgánicos son sustancias que están constituidas por dos o más elementos químicos distintos que se combinan químicamente en cierta forma y proporción, mientras que las fórmulas químicas son combinación de símbolos químicos que muestra qué elementos forman un compuesto y el número de átomos de cada uno de ellos, por lo que dichas fórmulas químicas representan a los todos compuestos químicos, ya sean orgánicos o inorgánicos. (Ondarse, 2021)
P2.2. Todo compuesto inorgánico es una sustancia que no forma cadenas estructurales con el C.
Un compuesto inorgánico es todo aquel que no tiene como principal elemento el carbono y en el que no ocurre un enlace covalente entre el carbono y el hidrógeno.
Se denomina compuesto químico inorgánico a aquellos compuestos que están formados por distintos elementos, pero en los que su componente principal no siempre es el carbono, siendo el agua, los metales y los no metales los más abundantes en su composición. (Tortajada Genaro et al., 2013)
Ejemplo:
- H2O
- NaCl
- CaO
*Se puede observar que ningún compuesto tiene como elemento principal al C, utilizando mayoritariamente a los elementos metálicos y no metales.
P2.3: Todo compuesto inorgánico separa estructuralmente sus átomos de carbono.
Argumentación: La característica principal que tienen los átomos de carbono y que no tiene el resto de los elementos químicos, o lo poseen en menor cantidad como es el caso del silicio, es la concatenación, es decir, la capacidad de enlazarse o unirse consigo mismo formando grandes cadenas o anillos muy estables; propiedad característica de los compuestos orgánicos, pero, en cambio, los compuestos inorgánicos tienen la facultad de separar sus átomos de carbono entre sí (en el caso de que el compuesto tenga más de uno). (Wöhler, n.d.)
P3. Ningún compuesto inorgánico es compuesto orgánico.
Los compuestos orgánicos se basan principalmente en carbono, en combinación con otros elementos. De forma general, encontramos carbono e hidrógeno, oxígeno, nitrógeno, azufre y fósforo. En cambio, los compuestos inorgánicos se forman con cualquier elemento de la tabla periódica. (Calderón et al., 2014)
P4.1: Algún compuesto inorgánico según su función química es óxido.
Para dividir a los compuestos inorgánicos se ha utilizado el criterio “función química”, el cuál se refiere a un grupo o familia de compuestos que tienen propiedades semejantes debido a que en su composición tienen un átomo o grupo de átomos característicos llamado grupo funcional.
Un óxido es un compuesto binario que en su estructura tienen un elemento químico unido al Oxígeno de valencia -2, este elemento puede ser tanto un metal cómo un no metal.
Los óxidos pueden presentarse en los tres estados físicos de la materia. (Ortiz, n.d.)
Ejemplo:
- Óxido clórico (Cl2O3).
- Óxido ferroso (FeO).
- Óxido de aluminio (Al2O3).
P4.1.1.1 Algún óxido es óxido ácido.
Los óxidos ácidos o anhídridos son compuestos que contienen en su estructura molecular un no metal enlazado de manera covalente a los átomos de oxígeno. Además, presenta propiedades físicas y químicas. Su reacción química de formación se conoce como reacción de Combinación o Síntesis.
Ejemplo:
- Óxido Nitroso. (N2O3)
- Óxido carbónico (CO2)
- Óxido perclórico (Cl2O7)
P41.1.2 Algún óxido es óxido básico.
Son sólidos y solubles en agua. Se forman por enlace iónico entre un metal (valencia fija o variable) y el oxígeno (O-2) . (Melo , 2014)
Ejemplo:
- Óxido de calcio (CaO)
- Óxido de plata (Ag2O)
- Óxido plúmbico (PbO2)
P4.1.1.3 Algún óxido es peróxido.
Un peróxido es un compuesto iónicos porque tienen un catión (metal) y el anión que es el grupo peróxido
(O2)-2
• El grupo peróxido tiene un enlace oxígeno-oxígeno, por lo tanto el número de oxidación de cada átomo de oxígeno es -1 y de esta forma dar la carga -2 a todo grupo peróxido.
O-O.
• Son solubles en agua. (Melo , 2014)
Ejemplo:
- Peróxido de sodio (Na2O2)
- Peróxido de aluminio (Al2O6)
- Peróxido de bario (BaO2)
P4.1.1.4 Algún óxido es óxido salino
Las principales características de los óxidos salinos son que son sólidos. Además, son compuestos que resultan de la combinación de sus dos óxidos (óxidos de metales que tienen valencias +1 +2, +2 +3, y también +2 y +4). Se forman principalmente con los óxidos del Cu, Fe, Ni, Co, Cr, Mn, Pb, Sn. P (Alaguna , 2014)
Ejemplo:
- Óxido ferroso- férrico (Fe3O4)
- Óxido cromoso- crómico (Cr3O4)
P4.1.2: Algún compuesto inorgánico según su función química es hidruro.
Los hidruros son compuestos binarios formados por átomos de hidrógeno y de otro elemento, ya sea un metal o no metal. Existen tres tipos de hidruros: los metálicos, los hidrácidos y los no metálicos.(Química.es, n.d.)
(Pérez , 2019)
P4.1.3: Algún compuesto inorgánico según su función química es hidróxido.
Los hidróxidos es un compuesto que se forma cuando el anión OH- se une a un radical o a un elemento. En su estructura, los hidróxidos presentan al grupo OH- unido a un metal. (J & A, 2019)
Ejemplo:
- Hidróxido de Aluminio (Al(OH)3)
- Hidróxido de Zinc (Zn(OH)2)
- Hidróxido de Potasio (K(OH))
P4.1.4: Algún compuesto inorgánico según su función química es ácido.
Son compuestos ternarios formados por un no metal, oxígeno e hidrógeno. Se produce a partir del óxido ácido o anhídrido correspondiente añadiéndole una molécula de agua (H2O). (Dr. Iranzo , 1945) (Calvo-Flores, n.d.)
Ejemplos:
- Ácido hipocloroso (HClO)
- Ácido ortogermánico (H4GeO4)
- Ácido bórico (H3BO3)
P4.1.5: Algún compuesto inorgánico según su función química es sal.
En esta categoría existen varios tipos de sales, las cuales se presentarán a continuación.
- Sales hidracidas: Se obtienen sustituyendo los hidrógenos del ácido hidrácido correspondiente por un metal. Se nombran con el nombre del no metal terminado en –uro seguido del nombre del metal.
- Sales ácidas: Las soluciones acuosas de sales pueden tener un comportamiento ácido o básico porque sus iones disociados pueden reaccionar con el agua e intercambiar protones (reacción de hidrólisis).
Son compuestos ternarios formados por un metal, un no metal y el oxígeno. Se obtiene a partir de los ácidos oxácidos sustituyendo los hidrógenos de éstos por un metal.
- Sales neutras: una sal en la que el ácido y la base se neutralizan uno al otro. (MIQ: Formulación Y Nomenclatura de Sales, 2022)
P4.2.1: Algún compuesto químico según el número de elementos es binario.
Los compuestos químicos formados por 2 elementos químicos iguales o diferentes se denominan binarios. Las moléculas binarias inorgánicas más sencillas son los gases diatómicos formados por átomos de la misma especie, estos son: F2, Cl2, Br2, I2, O2, N2, H2. Pero, las que contienen 2 átomos diferentes pueden ser covalentes o iónicas. (Universidad de La Punta , 2011)
Ejemplo:
- Sulfuro de hidrógeno (H2S)
- Óxido sulfúrico (SO3)
- óxido de bario (BaO)
P4.2.2 Algún compuesto inorgánico según el número de elementos es terciario.
Se denominan terciarios a los compuestos que tienen 3 elementos. (Universidad de La Punta , 2011)
Ejemplos:
- Ácido ortosilícico (H4SiO4)
- Hipoclorito de sodio (NaClO)
- Nitrato de litio (Li(NO3))
P4.2.3 Algún compuesto inorgánico según el número de elementos es cuaternario.
Se clasifican como compuestos inorgánicos cuaternarios a los compuestos que tienen 4 elementos en su estructura. (Universidad de La Punta , 2011) (Diferenciador , n.d.)
Ejemplos:
- Sulfato ácido de Sodio (NaHSO4)
- Carbonato ácido de Potasio (KHCO3).
- Sulfato ácido de calcio.(CaHSO4 )
Referencias:
- Alaguna , J. (2014). OXIDOS SALINOS. Prezi.com. https://bit.ly/342o8Jr
- Calderón, L.,Quintana, F., Cabanne, G. S., Lougheed, S. C., & Tubaro, P. L. (2014). Phylogeography and genetic structure of two Patagonian shag species (Aves: Phalacrocoracidae). Molecular Phylogenetics and Evolution, 72, 42–53. https://doi.org/10.1016/j.ympev.2013.12.011
- Calvo-Flores, F. (n.d.). Formulación de Química Orgánica . Retrieved April 20, 2023, from https://www.ugr.es/~fgarciac/pdf_color/formulacioninor.pdf
- Diferenciador . (n.d.). Diferencia entre compuesto orgánico y compuesto inorgánico. Diferenciador. https://www.diferenciador.com/compuestos-organicos-e-inorganicos/amp/
- Dr. Iranzo . (1945). ÁCIDOS Y BASES. https://digitum.um.es/xmlui/bitstream/10201/25521/1/N%C2%BA%2028%20%20%C3%81cidos%20y%20bases.pdf
- J, P. P., & A, G. (2019). Definición de hidróxido . Google.com. https://www.google.com/url?sa=t&source=web&rct=j&url=https://definicion.de/hidroxido/&ved=2ahUKEwj53Nmy9oP-AhUuRDABHQsKCEwQFnoECDsQAQ&usg=AOvVaw2k68C0eQPNqldTkPQ5JJmU
- Lifeder Educación . (2022). ¿Qué son los COMPUESTOS INORGÁNICOS? Propiedades, tipos y ejemplos👩🔬. Www.youtube.com. https://youtu.be/Jv9CpoR21nk
- Melo , L. (2014). Óxidos Básicos. Prezi.com. https://bit.ly/339tSBT
- MIQ: Formulación y nomenclatura de sales. (2022). Agrarias.campus.mdp.edu.ar. https://agrarias.campus.mdp.edu.ar/mod/page/view.php?id=4196
- Ondarse, D. (2021). Fórmula Química - Concepto, tipos, partes y ejemplos. Concepto.de. https://concepto.de/formula-quimica/
- Ortiz, L. (n.d.). PREPARATORIA ABIERTA PUEBLA FUNCIONES QUIMICAS INORGANICAS Nomenclatura y Formulación ELABORÓ LUZ MARÍA ORTIZ CORTÉS. Retrieved April 20, 2023, from https://preparatoriaabiertapuebla.com.mx/wp-content/uploads/2021/12/FUNCIONES-QUIMICAS-INORGANICAS.pdf
- Pérez , B. (2019). Hidrógeno y los hidruros metálicos. Google.com. https://www.google.com/url?sa=t&source=web&rct=j&url=https://www.uaeh.edu.mx/docencia/P_Presentaciones/Sahagun/industrial/2019/Hidrogeno-y-los-hidruros-metalicos.pdf&ved=2ahUKEwj5kKqiwbj-AhWUTTABHYZxDuIQFnoECFIQAQ&usg=AOvVaw3iWgezL_hdsDlsHN56zl3_
- Química.es. (n.d.). Hidruro. Www.quimica.es. Retrieved April 20, 2023, from https://www.quimica.es/enciclopedia/Hidruro.html
- Tortajada Genaro, L. A., Morais Ezquerro, S. B., Atienza Boronat, M. J., & Herrero Villen, M. A. (2013, September 9). UN PREÁMBULO A LA QUÍMICA GENERAL. M.riunet.upv.es; Editorial Universitat Politècnica de València. https://m.riunet.upv.es/handle/10251/70948
- Universidad de La Punta . (2011). Clasificación de los Compuestos | Química. Contenidosdigitales.ulp.edu.ar. http://contenidosdigitales.ulp.edu.ar/exe/quimica/clasificacin_de_los_compuestos.html#:~:text=%2D%20Seg%C3%BAn%20el%20n%C3%BAmero%20de%20elementos
- Wöhler, F. (n.d.). La Química del Carbono. https://www7.uc.cl/sw_educ/educacion/grecia/plano/html/pdfs/cra/quimica/NM2/RQ2O102.pdf