Mentefacto Átomo
Paquete proposicional
Supraordinada
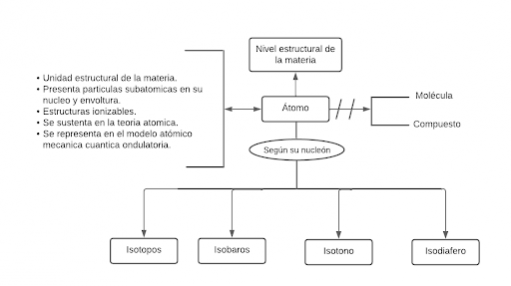
P1:Todo átomo es el nivel estructural de la materia.
Isoordinadas
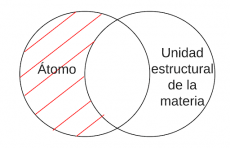
P2.1: Todo átomo es una unidad estructural de la materia.
P2.2: Todo átomo es el nivel que presenta partículas subatómicas en su núcleo y envoltura.
P2.3: Todo átomo es una estructura ionizable.
P2.4: Todo átomo es aquél que se sustenta en la teoría atómica.
P2.5: Todo átomo es representado en el modelo mecánica cuántica ondulatoria.
Exclusión
P3.1: Ningún átomo es molécula.
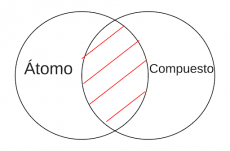
P3.2: Ningún átomo es compuesto.
Infraordinadas
P4.1: Algún átomo es Isótopo.
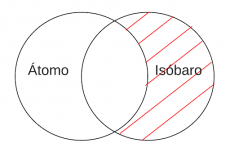
P4.2: Algún átomo es Isóbaro.
P4.3: Algún átomo es Isotono.
P4.4: Algún átomo es Isodiafero.
Mentefactos proposicionales
Argumentaciones
P1:Todo átomo es el nivel estructural de la materia
Arg: basada en la teoría atómica de la materia y en nuestra comprensión actual de la estructura y comportamiento de los átomos. Los átomos son los bloques de construcción básicos de la materia y su estudio nos ha permitido comprender y controlar las propiedades de la materia en todos los niveles.
P2.1: Todo átomo es Unidad estructural de la materia
Arg: Los átomos son las unidades más pequeñas de un elemento químico y están compuestos por un núcleo central rodeado por electrones. Los átomos se combinan entre sí para formar moléculas y compuestos, lo que da lugar a la gran variedad de sustancias en la naturaleza. Los átomos son la base de la química y su estudio nos ha permitido entender y controlar las propiedades de la materia a nivel microscópico.
P2.2: Todo átomo es el nivel que presenta partículas subatómicas en su núcleo y envoltura.
Arg: Los átomos están compuestos de partículas subatómicas, como protones, neutrones y electrones. La presencia de estas partículas es esencial para la estabilidad y comportamiento de los átomos. La distribución de estas partículas subatómicas en el átomo es importante para su estabilidad.
P2.3: Todo átomo es una estructura ionizable.
Arg: La ionización se refiere al proceso mediante el cual un átomo gana o pierde electrones para formar un ion con carga eléctrica. Esto se puede ver en todos los elementos de una forma u otra, normalmente esta ionización se ve reflejada en la formación de compuestos, en el caso de los menos reactivos como los gases nobles se ve reflejada en su plasma, ya que para llegar a ese estado es necesario ionizar el aire lo suficiente como para que los átomos están en constante pérdida y ganancia de electrones.
P2.4: Todo átomo es aquel que se sustenta en la teoría atómica.
Arg: En química, el atomismo es la teoría científica de las propiedades de la materia, que se compone de unidades discretas llamadas átomos. Originalmente, un concepto filosófico en la antigua Grecia, ganó reconocimiento científico a principios del siglo XIX cuando los descubrimientos en química demostraron que la materia en realidad se comportaba como si estuviera hecha de átomos.
P2.5: Todo átomo es representado en el modelo mecánica cuántica ondulatoria.
Arg: Los filósofos griegos Demócrito y Leucipo creían que la materia constaba de partículas indivisibles llamadas átomos. Esta visión prevaleció hasta finales del siglo XVIII, cuando reapareció el concepto de átomo y Dalton, Thomson, Rutherford, Bohr, Sommerfeld y otros crearon un modelo de mecánica cuántica (tabla adjunta) para explicar el concepto de átomo, su composición química, sustancia, reacción y sus propiedades. Actualmente, un átomo se define como la partícula más pequeña de un elemento que es divisible y está formado por partículas subatómicas (electrones, neutrones, protones) que constan del núcleo del átomo, donde se encuentran los protones y los neutrones, que forman la masa del átomo y niveles de energía, u orbitales, en los que los electrones giran con una determinada energía.
P3.1: Ningún átomo es molécula.
Arg: Los átomos se combinan para formar moléculas para compartir electrones y completar las capas finales. De esta forma permanecerán unidos entre sí por enlaces químicos, estando determinada la separación entre los átomos enlazados por el equilibrio de las fuerzas de atracción y repulsión entre estos átomos.
P3.2: Ningún átomo es compuesto.
Arg: Los átomos son la unidad fundamental de un elemento y no pueden ser divididos en partes más pequeñas sin perder sus propiedades químicas y físicas. Los compuestos químicos, por otro lado, están formados por dos o más elementos diferentes y pueden ser separados en sus elementos constituyentes mediante procesos químicos.
P4.1: Algún átomo es Isótopo
Arg: Los átomos que tienen el mismo número de protones, pero diferente número de neutrones, se llaman isótopos. Por lo tanto, tienen el mismo número atómico (Z) y diferentes números másicos (A). Los isótopos tienen diferentes masas porque tienen diferente número de neutrones.
P4.2: Algún átomo es Isóbaro
Arg: En otras palabras, el origen de una especie isóbara tiene lugar cuando dos núcleos atómicos exhiben el mismo número neto de protones y neutrones para sus respectivas especies. A pesar de ello, la cantidad de protones y neutrones que forman parte de dicho total es diferente.
P4.3: Algún átomo es Isotono
Arg: El número de protones en su núcleo se llama "número atómico" y se usa para ordenar los elementos en la tabla periódica. Sin embargo, los átomos pertenecientes a un mismo elemento químico pueden tener diferente número de neutrones en sus núcleos; estas variedades se llaman "isótopos".
P4.4: Algún átomo es Isodiafero
Arg: Si pudiéramos romper instantáneamente cualquier tipo de materia en pequeños pedazos. Obtenemos sus ingredientes más simples. De hecho, este proceso no puede realizarse fuera de laboratorios especializados, porque estos componentes, se llaman átomos y son muy pequeños.
Referencias
- Fernández Ponce, R. (2017). Elemento, átomo y sustancia simple. Una reflexión a partir de la enseñanza de la Tabla Periódica en los cursos generales de Química - PDF Descargar libre. Docplayer.es. https://docplayer.es/30992559-Elemento-atomo-y-sustancia-simple-una-reflexion-a-partir-de-la-ensenanza-de-la-tabla-periodica-en-los-cursos-generales-de-quimica.html